Cobertura especial coronavirus
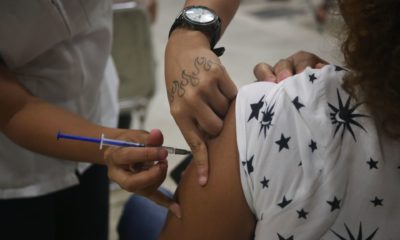
Llaman a priorizar pruebas Covid en México
Ciudad de México.— En caso de escasez de pruebas diagnósticas de Covid-19, la CONCANACO SERVYTUR México llama a priorizar el uso de PCR y test rápidos de antígenos para población vulnerable, profesionales de la salud y personal de servicios esenciales y presenciales con síntomas respiratorios.
La realización de pruebas de diagnóstico de Covid es un pilar fundamental en el combate a la enfermedad recordó el presidente de la Confederación, Héctor Tejada Shaar.
Sin embargo, en situaciones de escasez de pruebas es necesario, como recomienda la Organización Mundial de la Salud (OMS), priorizar su uso, siendo no aconsejadas para individuos asintomáticos o como requisito para salir del aislamiento y para acceder a lugares públicos.
LEE Sector Salud rechaza uso de pruebas sanguíneas para diagnosticar Covid
“Estamos viviendo un escenario inusual con un elevado índice de contagios y debemos proteger la salud de nuestros colaboradores y del resto de la población, pero siempre manteniendo el crecimiento económico del sector de Comercio, Servicios y Turismo, del que dependen millones de familias en México”, explicó el presidente de CONCANACO SERVYTUR México, Héctor Tejada Shaar.
Por tal motivo, el Consejo Técnico del IMSS propuso el trámite de permisos de incapacidad con la única presentación de un cuestionario de síntomas, informe sobre padecimientos preexistentes e historial de vacunación; dicha iniciativa podría resultar útil en casos concretos y excepcionales, siempre y cuando exista honestidad por parte del colaborador y no se preste a abusos.
Tejada Shaar explicó que los empresarios en México se han conducido con responsabilidad y solidaridad desde el inicio de la pandemia, velando por la salud de sus colaboradores y, en general, de la población, sin escatimar en recursos humanos y económicos para frenar la propagación del virus.
La sana distancia, la pauta de vacunación completa, el uso adecuado de cubrebocas y la ventilación continúan siendo las medidas más efectivas para prevenir el contagio. Anticipar las visitas a comercios, realizar la adquisición de productos o servicios a través de comercio electrónico y optar por espacios abiertos también resulta útil para reducir el riesgo de exposición al virus.
ebv
Dejanos un comentario:
Cobertura especial coronavirus
Cofepris avala tratamiento oral de Pfizer para Covid-19
Podría ser comercializado

Ciudad de México.— La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) avaló el tratamiento antiviral oral contra el Sars-Cov 2 de Pfizer.
El Comité de Moléculas Nuevas de la Comisión Federal emitió una opinión favorable para dicho tratamiento contra Covid-19.
Hasta el momento, el tratamiento tiene la aprobación para su uso de emergencia en el país.
Sin embargo, la empresa farmacéutica busca la comercialización en todo el país a través de la obtención del registro sanitario ante la Cofepris.
Te recomendamos leer: Pirola en aumento; senadores solicitan informe de variante de Covid-19
Pfizer señaló que el fármaco oral beneficiará principalmente a personas mayores de 50 años para evitar secuelas graves por la enfermedad.
“La opinión emitida por el Comité de Cofepris es, definitivamente, un paso adelante en el cuidado y protección de la población dado que necesitamos todas las herramientas que tengamos a nuestro alcance para disminuir los riesgos del Covid-19, sobre todo en personas mayores de 50 años y con factores de riesgo, quienes continúan siendo las más susceptibles de cuadros graves y hospitalización”, señaló Daniel Bustos, director médico de Pfizer.
Tras la opinión favorable para el tratamiento de Pfizer, la Cofepris deberá anunciar en las siguientes semanas si le concede el registro sanitario a Pfizer.
JAHA

Ciudad de México.— Un nuevo anticuerpo desarrollado en laboratorio logra bloquear todas las variantes del SARS-CoV-2, incluido Omicron y sus subvariantes.
El estudio realizado por expertos españoles, trabaja con un anticuerpo monoclonal. Esta es una proteína del sistema inmunitario desarrollada en el laboratorio, bautizado como 17T2.
El aislamiento del nuevo anticuerpo fue posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020.
A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos.
Te recomendamos: Cadena de farmacias ofrece vacunas contra Covid a menos de mil pesos
Se escogieron aquellos que generaban anticuerpos específicos contra la proteína de la espícula, que es la que permite al virus SARS-CoV-2 infectar las células humanas.
Mediante técnicas de ingeniería genética, el personal investigador reprodujo estos anticuerpos en el laboratorio, en fase preclínica de la investigación.
Los científicos evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2.
Así, los investigadores pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 y BA.2.86.
Los investigadores analizaron también en un modelo de ratón no solo la capacidad terapéutica del anticuerpo, sino también la capacidad preventiva.
Descubrieron que reduce de forma significativa las lesiones en los pulmones y la carga viral.
Antes de poder aplicarlo en pacientes habrá que llevar a cabo un ensayo clínico en humanos y, de momento, hay una patente europea activa asociada a este proyecto.
JAHA
Cobertura especial coronavirus
Cofepris avala uso de emergencia de Vacuna Patria
Se usará en personas mayores de 18 años con inmunidad previa
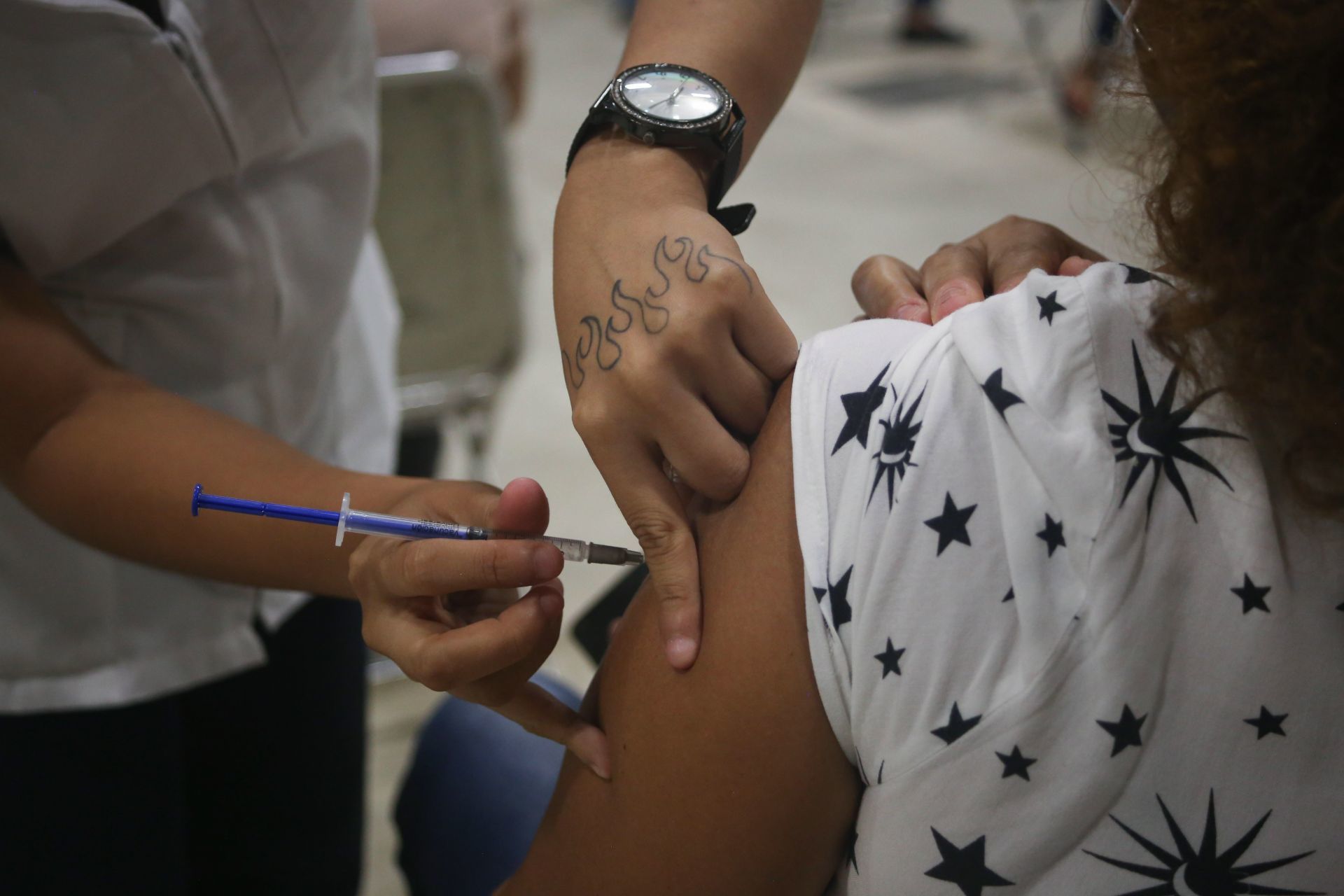
Ciudad de México.— El Comité de Moléculas Nuevas de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) aprobó el uso de emergencia de la vacuna Patria contra Covid-19.
El inmunológico del laboratorio Avi-Mex, para utilizarse en mayores de 18 años, con inmunidad previa.
En reunión extraordinaria, el biológico fue evaluado por expertos, quienes determinaron que la vacuna mexicana es segura y sirve como refuerzo.
El doctor Arturo Reyes Sandoval, miembro del Comité de Moléculas Nuevas, refirió que la evidencia demuestra que la vacuna es segura.
Que no se te pase: Dos Bocas trabajará a máxima capacidad el 28 de febrero: AMLO
En tanto, la doctora Lena Ruiz Azuara dijo que la evidencia de seguridad de la vacuna Patria es factible. Sin embargo, debe darse seguimiento a las personas que participaron en los estudios.
Mientras, el doctor Miguel Ángel Jorge Guevara consideró que es una vacuna segura, y los datos de los estudios presentados por Avi-Mex lo sustentan.
La doctora Rosana Pelayo Camacho aseguró que la presentación de la vacuna la hará accesible, y dará protección a la población a largo plazo.
Cofepris confirmó que pronto publicarán los estudios clínicos de la fase II y la fase II-III.
Los análisis de la vacuna patria tuvieron resultados favorables en ratones, hámsters, cerdos y ratas.
También realizaron pruebas en personas que no tenían ninguna vacuna contra SARS-CoV-2, y obtuvieron el mismo resultado, señalaron.
JAHA
Cobertura especial coronavirus
Vacuna de Moderna ya se comercializa en México
Se une a la de Pfizer como biológico comercializado

Ciudad de México.— La vacuna actualizada contra Covid-19 de Modera aprobada por la Organización Mundial de la Salud (OMS), comenzó a comercializarse en las farmacias de México.
El biológico se encuentra disponible desde el pasado 16 de enero y se une a la vacuna de Pfizer, que se comercializa desde diciembre.
Además, el gobierno mexicano suministra por su parte la rusa Sputnik y la cubana Abdala, ambas sin el aval de la OMS.
Que no se te pase: Hospitales Covid-19 capitalinos no están saturados: Sedesa
Asofarma, el representante legal en México de Moderna, explicó que la fórmula que se vende presenta respuesta inmune a las variantes circulantes, incluyendo la JN.1.
La Comisión Federal para la Protección Contra Riesgos Sanitarios (Cofepris) avaló el registro sanitario de la vacuna de Moderna el pasado 7 de diciembre.
Esto permitió su comercialización en el sector privado.
José Miguel Fonken Quiroga, director general de Asofarma, dijo que la vacuna se distribuirá a través de una red de vacunación establecida en México que incluye los sectores público y privado.
Así, estará disponible en centros de vacunación, consultorios médicos, hospitales y farmacias y puede utilizarse en personas de seis meses de edad en adelante.
“La vacuna es accesible y ofrece una respuesta inmune robusta contra las variantes circulantes dominantes”, señaló Fonken Quiroga en un comunicado.
La farmacéutica no reveló el costo de la vacuna, pero sería similar al que tiene el biológico de Pfizer que es de 848 pesos promedio.
JAHA
-

 Negocioshace 2 días
Negocioshace 2 díasActividad económica en marzo creció 2.6% a tasa anual
-

 Mundohace 2 días
Mundohace 2 días“Mi fe es más grade que mi enfermedad”: mujer con ELA al conocer al Papa Francisco
-

 Elecciones 2024hace 2 días
Elecciones 2024hace 2 díasArquidiócesis ora por proceso electoral en paz
-

 Negocioshace 2 días
Negocioshace 2 díasSedeco CDMX anticipa derrama de 5 mil millones para el Día del Niño