Cobertura especial coronavirus
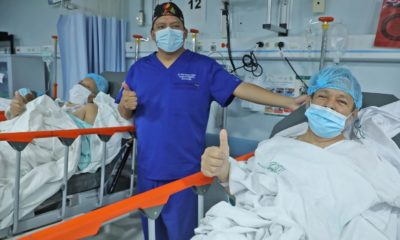
Guarderías del IMSS retoman actividades con un protocolo sanitario estricto
Ciudad de México.— Con la finalidad de ayudar a que las madres trabajadoras usuarias del servicio de guardería que se encuentran laborando en actividades esenciales no pierdan su empleo, el reinicio de actividades en estas unidades del Instituto Mexicano del Seguro Social (IMSS) se realizará este jueves 9 de julio.
Lo anterior, con apego a las recomendaciones de la Secretaría de Salud y de acuerdo con el semáforo de riesgo epidemiológico establecido por el gobierno federal y las disposiciones de los gobiernos estatales.
El servicio de guardería está considerado como una de las actividades esenciales que podrán tener operaciones, conforme al “ACUERDO por el que se establecen acciones extraordinarias para atender la emergencia sanitaria generada por el virus SARS-CoV2 de la Secretaría de Salud, publicado en el Diario Oficial de la Federación el 31 de marzo de 2020”.
Después de la encuesta para conocer cuántas usuarias se encuentran laborando en actividades esenciales y requieren el servicio para sus hijos, se analizó la necesidad y se determinó la fecha de reapertura con una operación diferenciada de acuerdo al semáforo epidemiológico por localidad.
De esta manera, si una unidad se encuentra en una localidad con semáforo epidemiológico en rojo, sólo se atenderá a hijos de trabajadoras en actividades esenciales y en un 25% de la capacidad.
En semáforo naranja, se incluirá a madres que estén trabajando sin importar si se trata de actividad esencial y se atenderá en un 50% de la capacidad de la guardería.
En semáforo amarillo será en un 75% de la capacidad, hasta llegar al 100% en semáforo verde.
Para la operación de las unidades se tiene considerado un protocolo sanitario seguro, basado en evidencias científicas sólidas, con el fin de que las guarderías sean el mejor lugar para la estancia de los niños.
Entre las principales acciones que se deberán seguir dentro de las instalaciones destacan el fortalecimiento de medidas generales de salud, higiene y limpieza, tales como: sana distancia, lavado de manos con técnica de la Organización Mundial de la Salud y el uso de cubrebocas y careta por parte del personal que atiende directamente a las niñas y los niños.
Asimismo, se reforzarán las acciones del filtro sanitario para niños, adultos y personal de la guardería, que contempla la instalación de una estación de higiene en el vestíbulo; se sanitizarán las suelas de los zapatos mediante un rociador o tapete sanitizante, se aplicará gel a base de alcohol al 60-80% en manos (excepto a lactantes) y se medirá la temperatura con termómetro infrarrojo.
En caso de que un niño sea identificado con fiebre o datos de enfermedad transmisible, se emitirá un formato de Valoración Médica para que sea llevado por sus padres a la Unidad Médica Familiar que le corresponde.
En el supuesto de que se confirmara un caso o casos de COVID-19 en alguno de los centros de atención infantil del IMSS, se seguirán las recomendaciones emitidas por el Responsable de Vigilancia Epidemiológica de la Unidad Médica de apoyo; el tiempo de suspensión de actividades y las medidas de aislamiento que se requieran quedarán supeditados a las indicaciones del Área de Vigilancia Epidemiológica del Seguro Social.
En cuanto al personal de las guarderías, es importante destacar que recibieron capacitación sobre COVID-19 durante la Jornada Nacional de Sana Distancia, tuvieron a su disposición diversos cursos en línea en la plataforma www.climss.imss.gob.mx: “Todo sobre la Prevención del COVID -19”, “Plan de acción para el hogar ante COVID-19″, “Atención, Cuidado y Desarrollo Integral Infantil” y “Retorno seguro al trabajo en guarderías”.
Las medidas y protocolos sanitarios que deberán seguirse han sido difundidos a los Órganos de Operación Administrativa Desconcentrada en todo el país para que a su vez se hagan llegar y se vigile su aplicación en las guarderías de prestación directa e indirecta.
ebv
Cobertura especial coronavirus
Vacuna de AstraZeneca se deja de comercializar por trombosis
En Europa
Madrid.— Desde este martes, la vacuna contra Covid-19 que lleva por nombre Vaxzeria desarrollada por AstraZeneca, dejó de comercializarse en Europa.
Lo anterior, luego de que la Comisión Europea validara una petición de la farmacéutica de retirar el biológico el pasado 5 de marzo.
La semana pasada, la compañía farmacéutica AstraZeneca admitió por primera vez que su vacuna contra el coronavirus podía provocar efectos secundarios como la trombosis.
Dicho efecto que ya se notificó en plena pandemia y que provocó la limitación de dicho vial durante el año 2021.
Sobre el tema: AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos ante el Tribunal Superior, y las víctimas y sus familiares en duelo piden daños y perjuicios por un valor estimado de hasta 100 millones de libras esterlinas.
La farmacéutica justificó la retirada de la vacuna contra Covid-19 por la falta de demanda y por el excedente de vacunas disponibles en el mercado.
“Dado que se han desarrollado múltiples vacunas actualizadas para variantes de Covid-19, ahora hay un excedente de vacunas disponibles. Esto ha provocado una disminución en la demanda de Vaxzervria, que ya no se fabrica ni suministra”, indica en un comunicado.
La vacuna de AstraZeneca contra Covid-19 fue la tercera en recibir la aprobación de los reguladores europeos, después de las elaboradas por Pfizer/BioTech y Moderna.
JAHA
Cobertura especial coronavirus
AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos
Londres.— AstraZeneca reconoció públicamente, por primera vez en un tribunal que su vacuna contra Covid-19 puede tener un efecto secundario extremadamente raro.
Sin embargo, de presentarse puede ser mortal, pues se puede desencadenar el síndrome de trombosis con trombocitopenia” (TTS).
Usuarios emprendieron en Reino Unido una acción colectiva contra el gigante farmacéutico y su vacuna para el Covid-19, desarrollada junto con la Universidad de Oxford.
Según The Telegraph, AstraZeneca rechazó las demandas, pero aceptó, en un documento legal que su vacuna “puede, en casos muy raros, causar TTS”.
Más para leer: Papa Francisco: “Cambio climático amenaza a Venecia”
Hasta ahora, se han presentado 51 demandas ante el Tribunal Supremo británico. En ellas, las víctimas y sus familiares reclaman una indemnización por daños y perjuicios estimada en 100 millones de libras esterlinas.
No es la única demanda que enfrenta AstraZeneca. En Alemania, un tribunal ordenó a la empresa revelar los datos sobre casos de trombosis posiblemente relacionados con su vacuna.
Lo anterior se da luego de que una mujer de 33 años que reclama una indemnización de 250 mil euros por los dolores que tuvo.
Además de otra de 17 mil 200 euros por concepto de ingresos que dejó de percibir y hasta 600 mil euros por futuras limitaciones.
Por ello, las autoridades solicitaron que AstraZeneca revele los casos de trombosis sufridos por gente que haya recibido la vacuna entre el 27 de diciembe de 2020 y el 19 de febrero de 2024.
La vacuna, según el tribunal, puede en principio favorecer la trombosis. El fabricante ya ha ofrecido información parcial que ahora deberá completar.
JAHA
Cobertura especial coronavirus
Cofepris avala tratamiento oral de Pfizer para Covid-19
Podría ser comercializado

Ciudad de México.— La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) avaló el tratamiento antiviral oral contra el Sars-Cov 2 de Pfizer.
El Comité de Moléculas Nuevas de la Comisión Federal emitió una opinión favorable para dicho tratamiento contra Covid-19.
Hasta el momento, el tratamiento tiene la aprobación para su uso de emergencia en el país.
Sin embargo, la empresa farmacéutica busca la comercialización en todo el país a través de la obtención del registro sanitario ante la Cofepris.
Te recomendamos leer: Pirola en aumento; senadores solicitan informe de variante de Covid-19
Pfizer señaló que el fármaco oral beneficiará principalmente a personas mayores de 50 años para evitar secuelas graves por la enfermedad.
“La opinión emitida por el Comité de Cofepris es, definitivamente, un paso adelante en el cuidado y protección de la población dado que necesitamos todas las herramientas que tengamos a nuestro alcance para disminuir los riesgos del Covid-19, sobre todo en personas mayores de 50 años y con factores de riesgo, quienes continúan siendo las más susceptibles de cuadros graves y hospitalización”, señaló Daniel Bustos, director médico de Pfizer.
Tras la opinión favorable para el tratamiento de Pfizer, la Cofepris deberá anunciar en las siguientes semanas si le concede el registro sanitario a Pfizer.
JAHA

Ciudad de México.— Un nuevo anticuerpo desarrollado en laboratorio logra bloquear todas las variantes del SARS-CoV-2, incluido Omicron y sus subvariantes.
El estudio realizado por expertos españoles, trabaja con un anticuerpo monoclonal. Esta es una proteína del sistema inmunitario desarrollada en el laboratorio, bautizado como 17T2.
El aislamiento del nuevo anticuerpo fue posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020.
A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos.
Te recomendamos: Cadena de farmacias ofrece vacunas contra Covid a menos de mil pesos
Se escogieron aquellos que generaban anticuerpos específicos contra la proteína de la espícula, que es la que permite al virus SARS-CoV-2 infectar las células humanas.
Mediante técnicas de ingeniería genética, el personal investigador reprodujo estos anticuerpos en el laboratorio, en fase preclínica de la investigación.
Los científicos evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2.
Así, los investigadores pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 y BA.2.86.
Los investigadores analizaron también en un modelo de ratón no solo la capacidad terapéutica del anticuerpo, sino también la capacidad preventiva.
Descubrieron que reduce de forma significativa las lesiones en los pulmones y la carga viral.
Antes de poder aplicarlo en pacientes habrá que llevar a cabo un ensayo clínico en humanos y, de momento, hay una patente europea activa asociada a este proyecto.
JAHA
-
Méxicohace 9 horas
Defender la vida: un llamado a la esperanza en el Día del Niño por Nacer
-
Estadoshace 10 horas
“La familia es la mejor escuela del amor y el perdón”, coinciden en CIFAM
-
Mundohace 14 horas
El Papa Francisco y su largo y sinuoso camino de salud
-
Felipe Monroyhace 10 horas
Otra vez, elecciones