Cobertura especial coronavirus
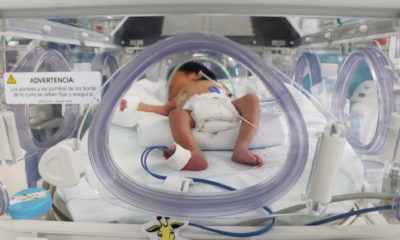
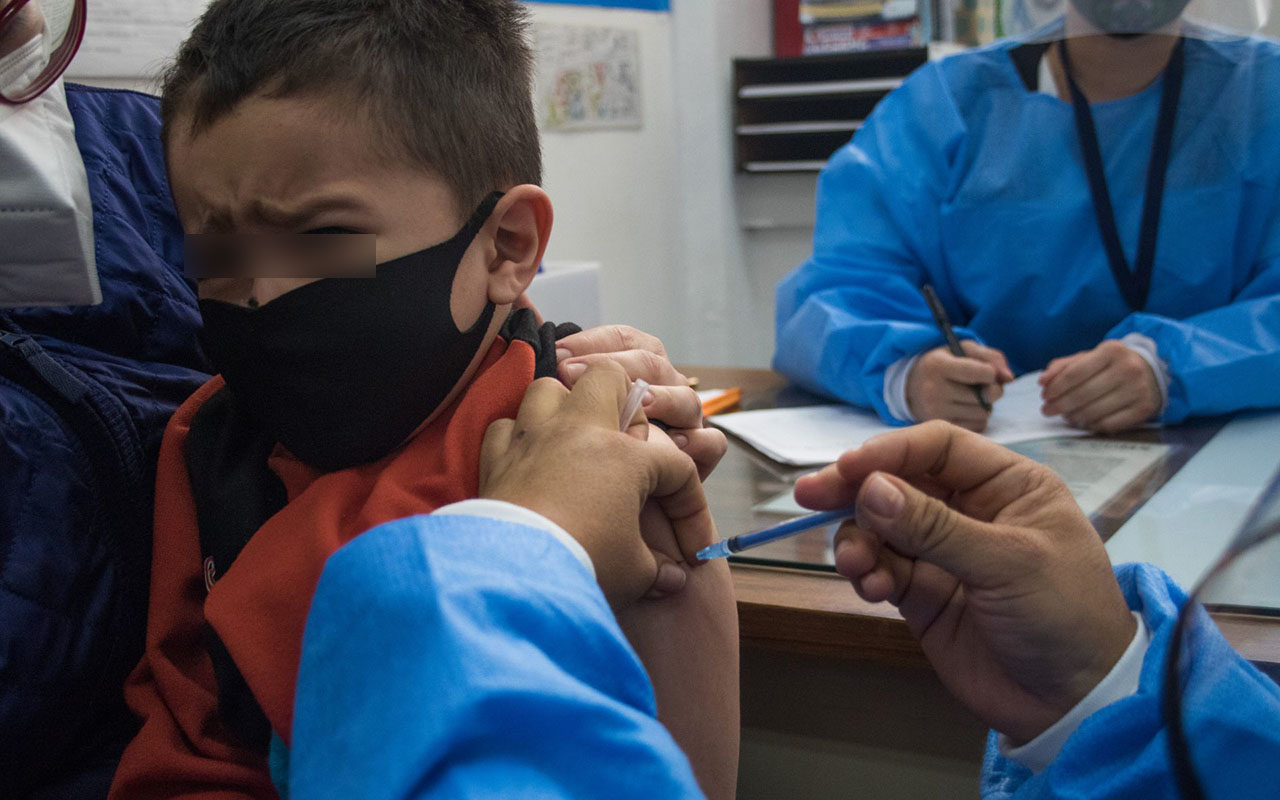
FDA autoriza vacunas contra Covid-19 de Pfizer y Moderna para bebés y niños
Estados Unidos.— La Administración de Drogas y Alimentos de Estados Unidos (FDA) autorizó el uso de emergencia de las vacunas Moderna y Pfizer-BioNTech para la prevención de Covid-19 para incluir el uso en niños a partir de los 6 meses de edad.
“Muchos padres, cuidadores y médicos han estado esperando una vacuna para niños más pequeños y esta acción ayudará a proteger a los menores de 6 meses de edad. Como hemos visto con los grupos de mayor edad, esperamos que las vacunas para los niños más pequeños brinden protección contra los resultados más graves del Covid-19, como la hospitalización y la muerte”, dijo Robert M. Califf, comisionado de la FDA.
Los Centros para el Control y la Prevención de Enfermedades (CDC) deberán ahora recomendar estas vacunas antes de que puedan comenzar las inyecciones.
“Al igual que con todas las vacunas para cualquier población, al autorizar las vacunas Covid-19 destinadas a grupos de edad pediátrica, la FDA garantiza que nuestra evaluación y análisis de los datos sea riguroso y exhaustivo”, dijo Peter Marks, director del Centro de Evaluación e Investigación Biológica de la FDA.
Asimismo, Peter Marks Aseguró que además de garantizar que los datos de estas vacunas cumplieron con los rigurosos estándares de la FDA, la convocatoria de un comité asesor por parte de la agencia fue parte de un proceso transparente para ayudar al público a tener una comprensión clara de los datos de seguridad y eficacia que respaldan la autorización de estas dos vacunas para poblaciones pediátricas.
LEE Esto dice la ley que protege a bebés por nacer en Florida
La vacuna Moderna Covid-19 se administra como una serie primaria de dos dosis, con un mes de diferencia, a personas de 6 meses a 17 años de edad. También está autorizada para proporcionar una tercera dosis de la serie primaria al menos un mes después de la segunda dosis para las personas de este grupo de edad que se ha determinado que tienen ciertos tipos de inmunodepresión.
La vacuna Pfizer-BioNTech Covid-19 se administra como una serie primaria de tres dosis en las que las dos dosis iniciales se administran con tres semanas de diferencia seguidas de una tercera dosis administrada al menos ocho semanas después de la segunda dosis en personas de 6 meses a 4 años de edad. años.
PUNTOS CLAVE:
Para la vacuna Moderna Covid-19, la FDA modificó la autorización de uso de emergencia (EUA) para incluir el uso de la vacuna en personas de 6 meses a 17 años de edad. La vacuna había sido autorizada para su uso en adultos mayores de 18 años.
Para la vacuna Pfizer-BioNTech Covid-19, la FDA modificó la EUA para incluir el uso de la vacuna en personas de 6 meses a 4 años de edad. La vacuna había sido autorizada para su uso en personas de 5 años de edad y mayores.
La evaluación y el análisis de la seguridad, la eficacia y los datos de fabricación de estas vacunas por parte de la FDA fueron rigurosos y completos, lo que respalda las EUA.
La agencia determinó que los beneficios conocidos y potenciales de las vacunas Moderna y Pfizer-BioNTech Covid-19 superan los riesgos conocidos y potenciales en las poblaciones pediátricas autorizadas para el uso de cada vacuna.
EFICACIA
Los datos de efectividad y seguridad evaluados y analizados por la FDA para la vacuna Moderna Covid-19 para respaldar la EUA para estas poblaciones pediátricas se generaron en dos ensayos clínicos en curso, aleatorizados, ciegos, controlados con placebo en los Estados Unidos y Canadá que incluyeron bebés , niños y adolescentes.
Niños de 6 meses a 5 años: respuestas inmunitarias de un subconjunto de 230 niños de 6 a 23 meses y un subconjunto de 260 niños de 2 a 5 años que recibieron una serie primaria de dos dosis de la vacuna Moderna Covid-19 a los 25 Se compararon microgramos (mcg) de ARN mensajero (ARNm) por dosis con las respuestas inmunitarias de 290 adultos de 18 a 25 años que recibieron dos dosis más altas de la vacuna en un estudio anterior que determinó que la vacuna era eficaz para prevenir la Covid-19. En estos análisis de la FDA, la respuesta inmunitaria a la vacuna, de ambos grupos de edad de niños, fue comparable a la respuesta inmunitaria de los adultos.
Se realizó un análisis de los casos de Covid-19 que ocurrieron al menos 14 días después de la segunda dosis entre aproximadamente 5400 niños de este grupo de edad sin evidencia de infección previa por SARS-CoV-2 durante el período de tiempo en el que la variante omicron era la predominante tensión circulante. En este análisis, entre los participantes de 6 a 23 meses de edad, el 64 % de los cuales tuvo un seguimiento ciego durante más de dos meses después de la segunda dosis, la vacuna tuvo una eficacia del 50,6 % en la prevención de Covid-19.
Entre los participantes de 2 a 5 años de edad, el 72 % de los cuales tuvo un seguimiento ciego durante más de dos meses después de la segunda dosis, la vacuna tuvo una eficacia del 36,8 % en la prevención de Covid-19.
Niños de 6 a 11 años de edad: Las respuestas inmunitarias de un subconjunto de 320 niños en este grupo de edad que recibieron una serie primaria de dos dosis de la vacuna Moderna COVID-19 a 50 mcg de ARNm por dosis se compararon con las respuestas inmunitarias entre 295 adultos de 18 a 25 años que recibieron dos dosis más altas de la vacuna en un estudio anterior que determinó que la vacuna es efectiva para prevenir el Covid-19. En el análisis de la FDA, la respuesta inmunitaria de los niños a la vacuna fue comparable a la respuesta inmunitaria de los adultos. Se determinó que un análisis adicional relacionado con la ocurrencia de casos de Covid-19 no era confiable debido a la baja cantidad de casos de Covid-19 que ocurrieron en los participantes del estudio.
Adolescentes de 12 a 17 años de edad: las respuestas inmunitarias de un subconjunto de 340 adolescentes en este grupo de edad que recibieron una serie primaria de dos dosis de la vacuna Moderna Covid-19 a 100 mcg de ARNm por dosis se compararon con las respuestas inmunitarias entre 296 adultos 18 a 25 años que recibieron dos dosis equivalentes de la vacuna en un estudio anterior que determinó que la vacuna es efectiva para prevenir el Covid-19. En este análisis, la respuesta inmunitaria de los adolescentes fue comparable a la respuesta inmunitaria de los participantes mayores.
También se realizó un análisis de casos de Covid-19 ocurridos al menos 14 días después de la segunda dosis entre aproximadamente 3.000 adolescentes de este grupo de edad sin evidencia de infección previa por SARS-CoV-2, en los que aproximadamente el 42% de los participantes tenían dos o más meses de seguimiento ciego después de la segunda dosis. En este análisis, entre los participantes de 12 a 17 años, la vacuna tuvo una efectividad del 93,3 % en la prevención de Covid-19. Los datos para este análisis se obtuvieron antes de que la variante omicron se convirtiera en la cepa circulante predominante.
LA SEGURIDAD
Los datos de seguridad para respaldar la EUA de la vacuna Moderna Covid-19 en personas de 6 meses a 17 años de edad son los siguientes:
Niños de 6 meses a 5 años de edad: La seguridad se evaluó en aproximadamente 1700 niños de 6 a 23 meses de edad que recibieron la vacuna y 600 que recibieron el placebo.
De estos, aproximadamente 1100 vacunados fueron seguidos por seguridad durante al menos dos meses después de la segunda dosis. Para los participantes de 2 a 5 años de edad, aproximadamente 3000 recibieron la vacuna y aproximadamente 1000 recibieron un placebo; aproximadamente 2200 vacunados fueron seguidos por seguridad durante al menos dos meses después de la segunda dosis.
En los participantes de ensayos clínicos de 6 meses a 5 años de edad, los efectos secundarios informados con mayor frecuencia en todos los subgrupos de edad incluyeron dolor, enrojecimiento e hinchazón en el lugar de la inyección, fiebre e hinchazón/sensibilidad en las axilas (o ingle) de los ganglios linfáticos en el mismo brazo (o muslo) como la inyección.
En los participantes de ensayos clínicos de 6 a 36 meses de edad, los efectos secundarios informados con mayor frecuencia también incluyeron irritabilidad/llanto, somnolencia y pérdida de apetito.
Los participantes de ensayos clínicos de 37 meses a 5 años de edad, los efectos secundarios informados con mayor frecuencia también incluyeron fatiga, dolor de cabeza, dolor muscular, escalofríos, náuseas/vómitos y rigidez en las articulaciones.
Niños de 6 a 11 años de edad: Se evaluó la seguridad en aproximadamente 3000 niños que recibieron la vacuna y aproximadamente 1000 niños que recibieron placebo. La mayoría de los vacunados (98,7 %) tuvieron al menos dos meses de seguimiento de seguridad después de la segunda dosis.
Adolescentes de 12 a 17 años de edad: Se evaluó la seguridad en aproximadamente 2500 participantes que recibieron la vacuna y 1200 que recibieron placebo. La mayoría de los vacunados (95,6%) tenían al menos seis meses de seguimiento después de la segunda dosis.
Los efectos secundarios informados con mayor frecuencia en los participantes del ensayo clínico tanto para el grupo de edad de 6 a 11 años como para el grupo de edad de 12 a 17 años que recibieron la vacuna incluyen dolor, enrojecimiento e hinchazón en el lugar de la inyección, cansancio, dolor de cabeza, dolor muscular, escalofríos , dolor en las articulaciones, ganglios linfáticos inflamados en la axila en el mismo brazo que la inyección, náuseas y vómitos y fiebre.
Evaluación de la vacuna Pfizer-BioNTech COVID-19 para niños de 6 meses a 4 años de edad
Los datos de eficacia y seguridad evaluados y analizados por la FDA para la vacuna Pfizer-BioNTech COVID-19 se generaron en un ensayo clínico en curso, aleatorizado, ciego, controlado con placebo en los Estados Unidos e internacionalmente, que inscribió a bebés y niños.
EFICACIA
Los datos de efectividad para respaldar la EUA en niños de 6 meses a 4 años de edad se basan en una comparación de las respuestas inmunitarias luego de tres dosis de la vacuna Pfizer-BioNTech Covid-19 en un subconjunto de niños en este grupo de edad a las respuestas inmunitarias entre adultos de 16 a 25 años que recibieron dos dosis más altas de la vacuna contra el Covid-19 de Pfizer-BioNTech en un estudio anterior que determinó que la vacuna es efectiva para prevenir el Covid-19.
El estudio se realizó en dos subgrupos de edad. Se comparó la respuesta inmunitaria a la vacuna de aproximadamente 80 niños, de 6 a 23 meses de edad, y aproximadamente 140 niños, de 2 a 4 años de edad, con la respuesta inmunitaria de aproximadamente 170 de los participantes mayores.
En estos análisis de la FDA, la respuesta inmunitaria a la vacuna para ambos grupos de edad de los niños fue comparable a la respuesta inmunitaria de los participantes mayores. Se determinó que un análisis adicional relacionado con la ocurrencia de casos no era confiable debido a la baja cantidad de casos de Covid-19 que ocurrieron en los participantes del estudio.
ebv
Dejanos un comentario:
Cobertura especial coronavirus
Vacuna de AstraZeneca se deja de comercializar por trombosis
En Europa
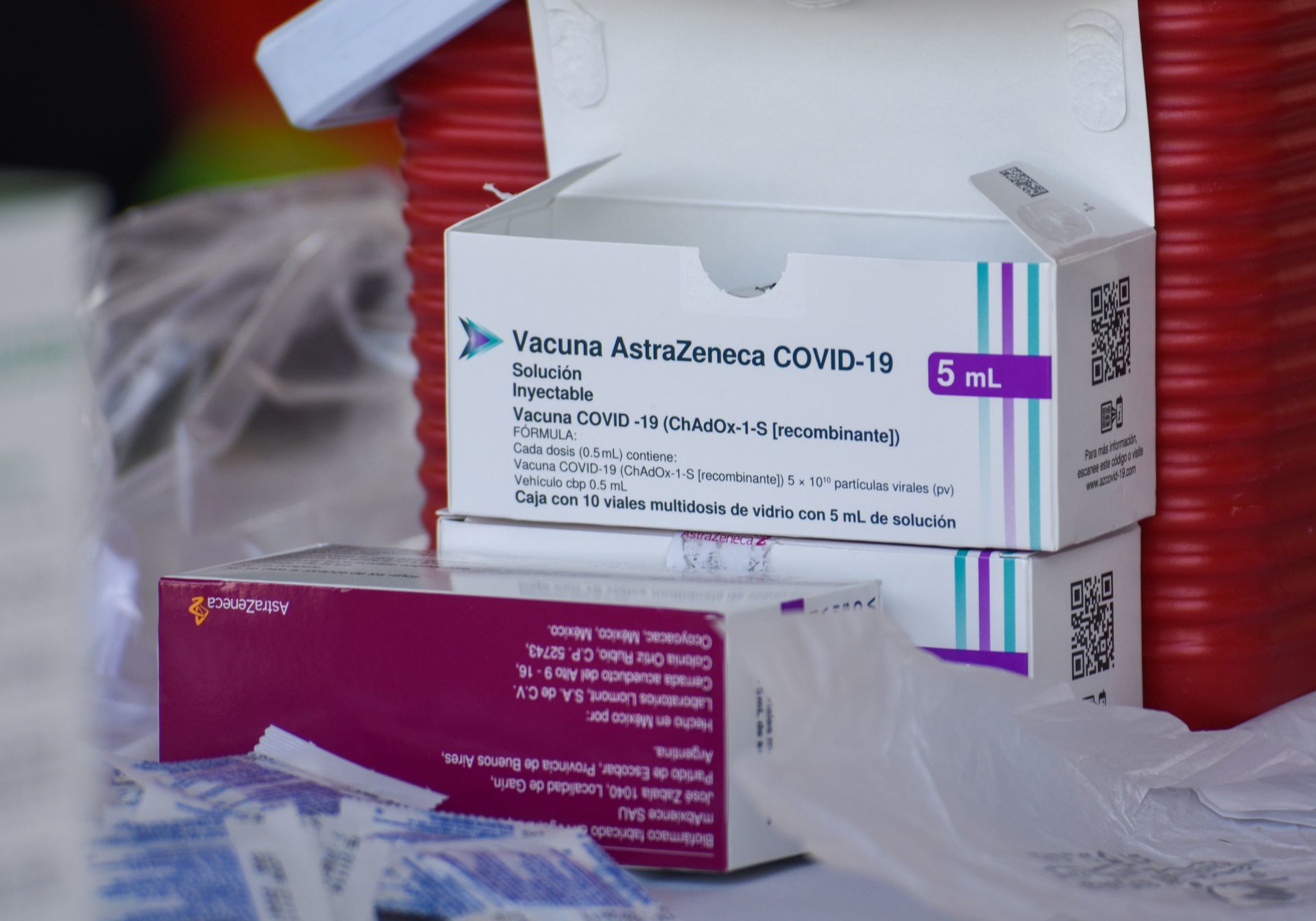
Madrid.— Desde este martes, la vacuna contra Covid-19 que lleva por nombre Vaxzeria desarrollada por AstraZeneca, dejó de comercializarse en Europa.
Lo anterior, luego de que la Comisión Europea validara una petición de la farmacéutica de retirar el biológico el pasado 5 de marzo.
La semana pasada, la compañía farmacéutica AstraZeneca admitió por primera vez que su vacuna contra el coronavirus podía provocar efectos secundarios como la trombosis.
Dicho efecto que ya se notificó en plena pandemia y que provocó la limitación de dicho vial durante el año 2021.
Sobre el tema: AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos ante el Tribunal Superior, y las víctimas y sus familiares en duelo piden daños y perjuicios por un valor estimado de hasta 100 millones de libras esterlinas.
La farmacéutica justificó la retirada de la vacuna contra Covid-19 por la falta de demanda y por el excedente de vacunas disponibles en el mercado.
“Dado que se han desarrollado múltiples vacunas actualizadas para variantes de Covid-19, ahora hay un excedente de vacunas disponibles. Esto ha provocado una disminución en la demanda de Vaxzervria, que ya no se fabrica ni suministra”, indica en un comunicado.
La vacuna de AstraZeneca contra Covid-19 fue la tercera en recibir la aprobación de los reguladores europeos, después de las elaboradas por Pfizer/BioTech y Moderna.
JAHA
Cobertura especial coronavirus
AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos
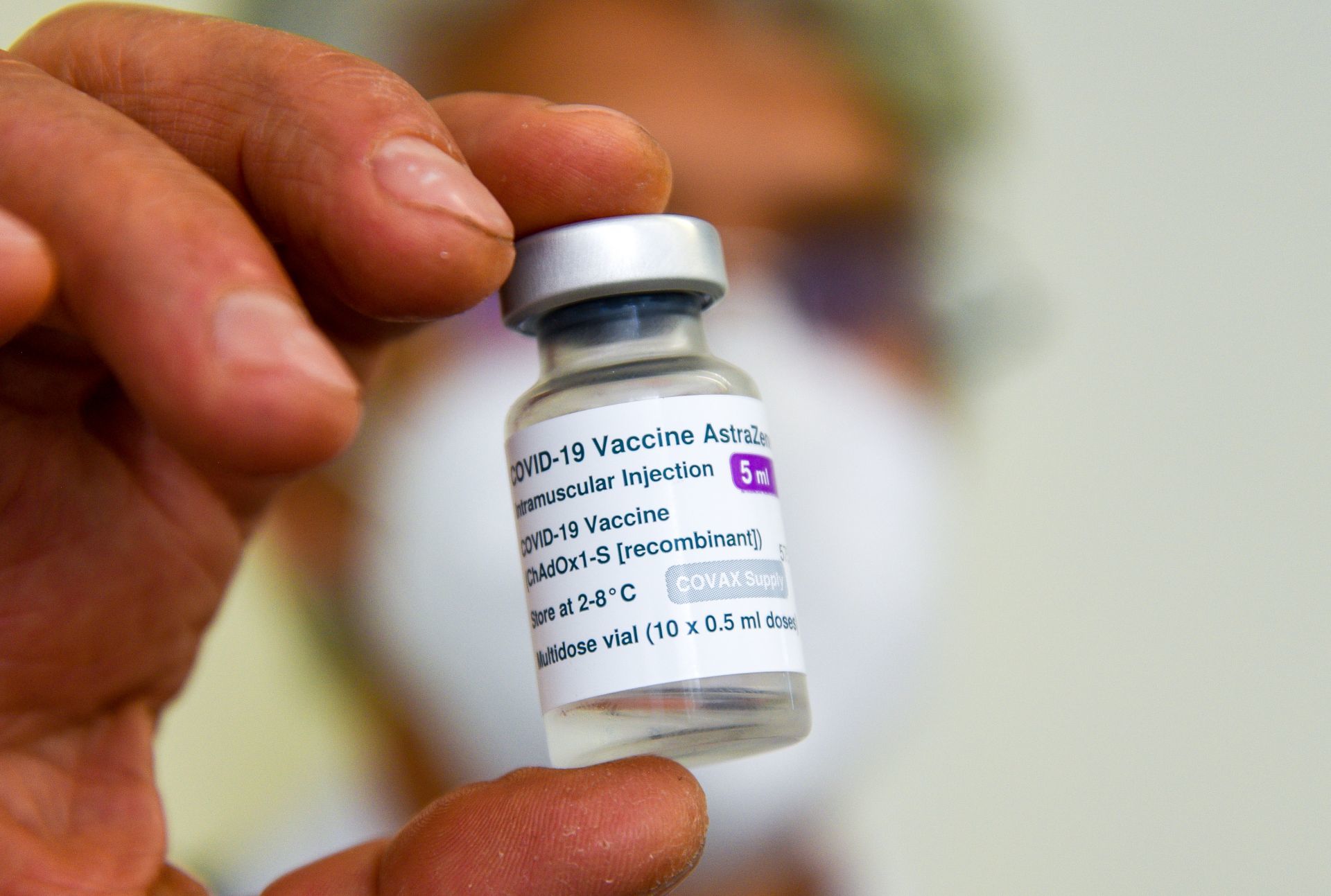
Londres.— AstraZeneca reconoció públicamente, por primera vez en un tribunal que su vacuna contra Covid-19 puede tener un efecto secundario extremadamente raro.
Sin embargo, de presentarse puede ser mortal, pues se puede desencadenar el síndrome de trombosis con trombocitopenia” (TTS).
Usuarios emprendieron en Reino Unido una acción colectiva contra el gigante farmacéutico y su vacuna para el Covid-19, desarrollada junto con la Universidad de Oxford.
Según The Telegraph, AstraZeneca rechazó las demandas, pero aceptó, en un documento legal que su vacuna “puede, en casos muy raros, causar TTS”.
Más para leer: Papa Francisco: “Cambio climático amenaza a Venecia”
Hasta ahora, se han presentado 51 demandas ante el Tribunal Supremo británico. En ellas, las víctimas y sus familiares reclaman una indemnización por daños y perjuicios estimada en 100 millones de libras esterlinas.
No es la única demanda que enfrenta AstraZeneca. En Alemania, un tribunal ordenó a la empresa revelar los datos sobre casos de trombosis posiblemente relacionados con su vacuna.
Lo anterior se da luego de que una mujer de 33 años que reclama una indemnización de 250 mil euros por los dolores que tuvo.
Además de otra de 17 mil 200 euros por concepto de ingresos que dejó de percibir y hasta 600 mil euros por futuras limitaciones.
Por ello, las autoridades solicitaron que AstraZeneca revele los casos de trombosis sufridos por gente que haya recibido la vacuna entre el 27 de diciembe de 2020 y el 19 de febrero de 2024.
La vacuna, según el tribunal, puede en principio favorecer la trombosis. El fabricante ya ha ofrecido información parcial que ahora deberá completar.
JAHA
Cobertura especial coronavirus
Cofepris avala tratamiento oral de Pfizer para Covid-19
Podría ser comercializado

Ciudad de México.— La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) avaló el tratamiento antiviral oral contra el Sars-Cov 2 de Pfizer.
El Comité de Moléculas Nuevas de la Comisión Federal emitió una opinión favorable para dicho tratamiento contra Covid-19.
Hasta el momento, el tratamiento tiene la aprobación para su uso de emergencia en el país.
Sin embargo, la empresa farmacéutica busca la comercialización en todo el país a través de la obtención del registro sanitario ante la Cofepris.
Te recomendamos leer: Pirola en aumento; senadores solicitan informe de variante de Covid-19
Pfizer señaló que el fármaco oral beneficiará principalmente a personas mayores de 50 años para evitar secuelas graves por la enfermedad.
“La opinión emitida por el Comité de Cofepris es, definitivamente, un paso adelante en el cuidado y protección de la población dado que necesitamos todas las herramientas que tengamos a nuestro alcance para disminuir los riesgos del Covid-19, sobre todo en personas mayores de 50 años y con factores de riesgo, quienes continúan siendo las más susceptibles de cuadros graves y hospitalización”, señaló Daniel Bustos, director médico de Pfizer.
Tras la opinión favorable para el tratamiento de Pfizer, la Cofepris deberá anunciar en las siguientes semanas si le concede el registro sanitario a Pfizer.
JAHA

Ciudad de México.— Un nuevo anticuerpo desarrollado en laboratorio logra bloquear todas las variantes del SARS-CoV-2, incluido Omicron y sus subvariantes.
El estudio realizado por expertos españoles, trabaja con un anticuerpo monoclonal. Esta es una proteína del sistema inmunitario desarrollada en el laboratorio, bautizado como 17T2.
El aislamiento del nuevo anticuerpo fue posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020.
A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos.
Te recomendamos: Cadena de farmacias ofrece vacunas contra Covid a menos de mil pesos
Se escogieron aquellos que generaban anticuerpos específicos contra la proteína de la espícula, que es la que permite al virus SARS-CoV-2 infectar las células humanas.
Mediante técnicas de ingeniería genética, el personal investigador reprodujo estos anticuerpos en el laboratorio, en fase preclínica de la investigación.
Los científicos evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2.
Así, los investigadores pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 y BA.2.86.
Los investigadores analizaron también en un modelo de ratón no solo la capacidad terapéutica del anticuerpo, sino también la capacidad preventiva.
Descubrieron que reduce de forma significativa las lesiones en los pulmones y la carga viral.
Antes de poder aplicarlo en pacientes habrá que llevar a cabo un ensayo clínico en humanos y, de momento, hay una patente europea activa asociada a este proyecto.
JAHA
-

 Negocioshace 3 días
Negocioshace 3 díasMexicana, acumula pérdidas millonarias en menos de un año de operación
-

 Estadoshace 3 días
Estadoshace 3 días“Soy hombre de familia y defiendo la vida”: diputado de Chihuahua desafía la agenda Woke
-

 Mundohace 2 días
Mundohace 2 díasTrabajadores de Starbucks anuncian huelga de cinco días en vísperas navideñas
-
 Méxicohace 3 días
Méxicohace 3 díasProponen un sistema integral de salud para garantizar medicamentos y vacunas a mexicanos