Cobertura especial coronavirus
En 20 días, IMSS otorgó más de 142 mil permisos COVID 4.0
Ciudad de México.— Trabajadores asegurados en el Instituto Mexicano del Seguro Social (IMSS) han tramitado 142 mil 16 permisos COVID, en su más reciente versión 4.0, entre el 6 y 26 de julio del presente año.
De esta forma se genera un documento homologable a la incapacidad temporal para el trabajo por cinco días, de manera remota y sin necesidad de acudir a su Unidad de Medicina Familiar (UMF) de adscripción.
Del total de permisos otorgados en dicho periodo, 66 mil 138 se concentran en Ciudad de México, Estado de México, Nuevo León y Jalisco.
Este servicio digital se otorga a la población trabajadora asegurada, e incluye a las Personas Trabajadoras Independientes y del Hogar, que presentan síntomas asociados a coronavirus como tos, fiebre, dificultad para respirar (disnea) y/o dolor de cabeza.
LEE Han comenzado a disminuir los casos de Covid-19: Gatell
Para tramitar este permiso no es necesario realizarse una prueba de COVID, ya que se recibe directamente vía electrónica la notificación del subsidio por enfermedad general que le corresponde al trabajador o trabajadora.
En los casos en que las personas no recuperen su salud al quinto día, la recomendación es que acudan a la Unidad de Medicina Familiar que les corresponde o al área de Urgencias para una valoración médica.
Para solicitar el Permiso COVID 4.0, el o la trabajadora deberá ingresar a la aplicación IMSS Digital, a liga: http://www.imss.gob.mx/covid-19/permiso o mediante el código QR disponible en la sección Permiso COVID-19, y registrar los siguientes datos: CURP, Número de Seguridad Social, Código Postal y el Captcha de validación.
Es necesario responder el cuestionario de sintomatología y en caso de contar con prueba positiva, adjuntar el documento en formato .pdf o .jpg en un máximo de cinco megabytes, junto con datos personales de correo electrónico, cuenta CLABE a 18 posiciones, teléfono y dirección para la emisión del permiso.
Todos los permisos tienen una duración de cinco días y en caso de que el asegurado tenga derecho al subsidio, el pago corresponde al 60 por ciento del salario registrado a partir del cuarto día, como ocurre para cualquier incapacidad temporal para el trabajo por enfermedad general, y se realizará mediante transferencia electrónica a la cuenta CLABE registrada.
Una vez que se realiza el trámite no podrá cancelarse y la o el asegurado deberá notificarlo a su centro de trabajo.
En las versiones previas (1.0, 2.0 y 3.0) se otorgaron 551 mil Permisos COVID. Esta versión 4.0 se encontrará disponible durante el periodo de alto índice de contagio, a fin de prevenir saturación de los servicios médicos.
Para solicitar más información sobre el Permiso COVID 4.0, las y los trabajadores pueden comunicarse al Call Center, en el teléfono 800 2222 668, opción 0.
ebv
Dejanos un comentario:
Cobertura especial coronavirus
AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos
Londres.— AstraZeneca reconoció públicamente, por primera vez en un tribunal que su vacuna contra Covid-19 puede tener un efecto secundario extremadamente raro.
Sin embargo, de presentarse puede ser mortal, pues se puede desencadenar el síndrome de trombosis con trombocitopenia” (TTS).
Usuarios emprendieron en Reino Unido una acción colectiva contra el gigante farmacéutico y su vacuna para el Covid-19, desarrollada junto con la Universidad de Oxford.
Según The Telegraph, AstraZeneca rechazó las demandas, pero aceptó, en un documento legal que su vacuna “puede, en casos muy raros, causar TTS”.
Más para leer: Papa Francisco: “Cambio climático amenaza a Venecia”
Hasta ahora, se han presentado 51 demandas ante el Tribunal Supremo británico. En ellas, las víctimas y sus familiares reclaman una indemnización por daños y perjuicios estimada en 100 millones de libras esterlinas.
No es la única demanda que enfrenta AstraZeneca. En Alemania, un tribunal ordenó a la empresa revelar los datos sobre casos de trombosis posiblemente relacionados con su vacuna.
Lo anterior se da luego de que una mujer de 33 años que reclama una indemnización de 250 mil euros por los dolores que tuvo.
Además de otra de 17 mil 200 euros por concepto de ingresos que dejó de percibir y hasta 600 mil euros por futuras limitaciones.
Por ello, las autoridades solicitaron que AstraZeneca revele los casos de trombosis sufridos por gente que haya recibido la vacuna entre el 27 de diciembe de 2020 y el 19 de febrero de 2024.
La vacuna, según el tribunal, puede en principio favorecer la trombosis. El fabricante ya ha ofrecido información parcial que ahora deberá completar.
JAHA
Cobertura especial coronavirus
Cofepris avala tratamiento oral de Pfizer para Covid-19
Podría ser comercializado

Ciudad de México.— La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) avaló el tratamiento antiviral oral contra el Sars-Cov 2 de Pfizer.
El Comité de Moléculas Nuevas de la Comisión Federal emitió una opinión favorable para dicho tratamiento contra Covid-19.
Hasta el momento, el tratamiento tiene la aprobación para su uso de emergencia en el país.
Sin embargo, la empresa farmacéutica busca la comercialización en todo el país a través de la obtención del registro sanitario ante la Cofepris.
Te recomendamos leer: Pirola en aumento; senadores solicitan informe de variante de Covid-19
Pfizer señaló que el fármaco oral beneficiará principalmente a personas mayores de 50 años para evitar secuelas graves por la enfermedad.
“La opinión emitida por el Comité de Cofepris es, definitivamente, un paso adelante en el cuidado y protección de la población dado que necesitamos todas las herramientas que tengamos a nuestro alcance para disminuir los riesgos del Covid-19, sobre todo en personas mayores de 50 años y con factores de riesgo, quienes continúan siendo las más susceptibles de cuadros graves y hospitalización”, señaló Daniel Bustos, director médico de Pfizer.
Tras la opinión favorable para el tratamiento de Pfizer, la Cofepris deberá anunciar en las siguientes semanas si le concede el registro sanitario a Pfizer.
JAHA

Ciudad de México.— Un nuevo anticuerpo desarrollado en laboratorio logra bloquear todas las variantes del SARS-CoV-2, incluido Omicron y sus subvariantes.
El estudio realizado por expertos españoles, trabaja con un anticuerpo monoclonal. Esta es una proteína del sistema inmunitario desarrollada en el laboratorio, bautizado como 17T2.
El aislamiento del nuevo anticuerpo fue posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020.
A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos.
Te recomendamos: Cadena de farmacias ofrece vacunas contra Covid a menos de mil pesos
Se escogieron aquellos que generaban anticuerpos específicos contra la proteína de la espícula, que es la que permite al virus SARS-CoV-2 infectar las células humanas.
Mediante técnicas de ingeniería genética, el personal investigador reprodujo estos anticuerpos en el laboratorio, en fase preclínica de la investigación.
Los científicos evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2.
Así, los investigadores pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 y BA.2.86.
Los investigadores analizaron también en un modelo de ratón no solo la capacidad terapéutica del anticuerpo, sino también la capacidad preventiva.
Descubrieron que reduce de forma significativa las lesiones en los pulmones y la carga viral.
Antes de poder aplicarlo en pacientes habrá que llevar a cabo un ensayo clínico en humanos y, de momento, hay una patente europea activa asociada a este proyecto.
JAHA
Cobertura especial coronavirus
Cofepris avala uso de emergencia de Vacuna Patria
Se usará en personas mayores de 18 años con inmunidad previa
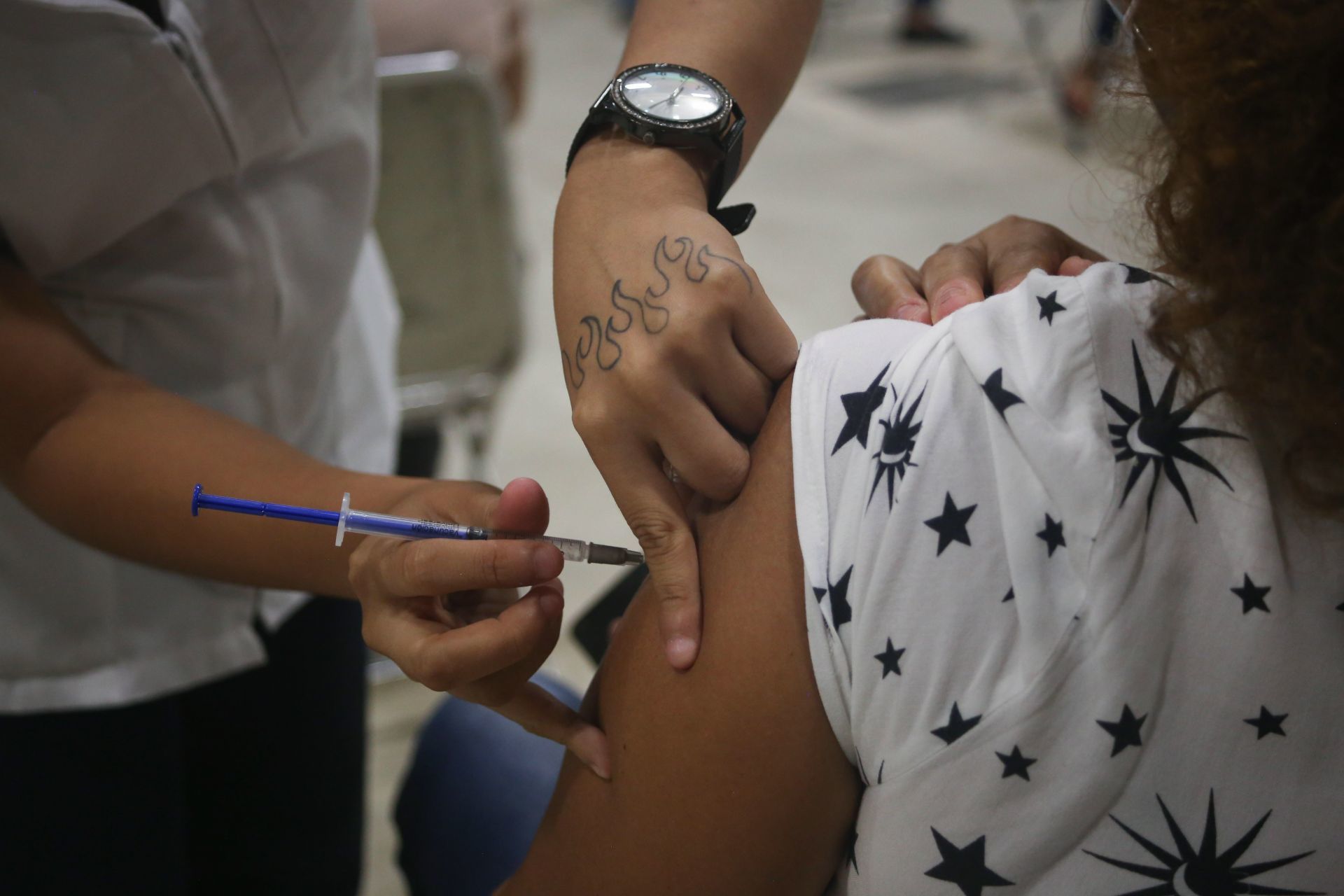
Ciudad de México.— El Comité de Moléculas Nuevas de la Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) aprobó el uso de emergencia de la vacuna Patria contra Covid-19.
El inmunológico del laboratorio Avi-Mex, para utilizarse en mayores de 18 años, con inmunidad previa.
En reunión extraordinaria, el biológico fue evaluado por expertos, quienes determinaron que la vacuna mexicana es segura y sirve como refuerzo.
El doctor Arturo Reyes Sandoval, miembro del Comité de Moléculas Nuevas, refirió que la evidencia demuestra que la vacuna es segura.
Que no se te pase: Dos Bocas trabajará a máxima capacidad el 28 de febrero: AMLO
En tanto, la doctora Lena Ruiz Azuara dijo que la evidencia de seguridad de la vacuna Patria es factible. Sin embargo, debe darse seguimiento a las personas que participaron en los estudios.
Mientras, el doctor Miguel Ángel Jorge Guevara consideró que es una vacuna segura, y los datos de los estudios presentados por Avi-Mex lo sustentan.
La doctora Rosana Pelayo Camacho aseguró que la presentación de la vacuna la hará accesible, y dará protección a la población a largo plazo.
Cofepris confirmó que pronto publicarán los estudios clínicos de la fase II y la fase II-III.
Los análisis de la vacuna patria tuvieron resultados favorables en ratones, hámsters, cerdos y ratas.
También realizaron pruebas en personas que no tenían ninguna vacuna contra SARS-CoV-2, y obtuvieron el mismo resultado, señalaron.
JAHA
-
Cinehace 3 días
“Mufasa: El Rey León” contará la historia del papá de Simba
-
Méxicohace 3 días
La CEM expresa pésame a familias del accidente en la carretera Capulín-Chalma
-
Cobertura especial coronavirushace 3 días
AstraZeneca reconoce que vacuna anticovid puede causar trombosis
-
Méxicohace 2 días
Pequeños aportan ideas para mejorar su escuela: Mexicanos Primero