Cobertura especial coronavirus
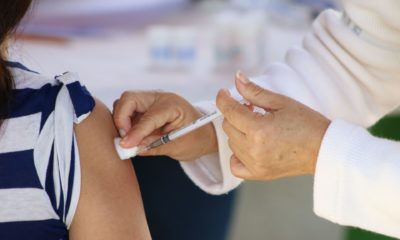
Unidad Temporal Covid-19, fue un centro de esperanza: Slim Domit
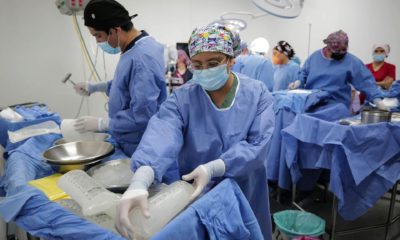
Ciudad de México.— La Unidad Temporal Covid-19 en el Centro Citibanamex, gracias al apoyo de las Fundaciones Carlos Slim, TELMEX Telcel e Inbursa, se consolidó como un modelo referente de atención hospitalaria temprana.
Con la labor heroica de más de 3 mil profesionales que atendieron a 9 mil 088 pacientes internados y diagnosticaron de manera oportuna a 13 mil 542 personas en ocho centros de evaluación habilitados en distintos puntos de la capital del país.
Durante 13 meses, en que ha estado en funcionamiento dicha infraestructura hospitalaria, la atención médica gratuita, incluyente y de alta calidad provista en la Unidad Temporal Covid-19 en el Centro Citibanamex es producto del impulso de la Fundación Carlos Slim en alianza con el Gobierno de la Ciudad de México, así como del apoyo de “Sumamos por México” conformada por empresas y fundaciones bajo la iniciativa de la Corporación Interamericana de Entretenimiento, Grupo CIE.
Fundación Carlos Slim, Fundación TELMEX Telcel y Fundación Inbursa aportaron mil 104 millones 902,501 pesos, de los mil 580 millones 590,574 pesos que se destinaron para la reconversión, equipamiento y operación de la Unidad Temporal, a fin de contribuir decididamente a la recuperación de la salud en los momentos más desafiantes de la pandemia.
LEE “Con colaboración, no hay reto que no podamos superar”: Slim Domit
Concluida la operación de la Unidad Temporal, se donarán a 18 hospitales del Gobierno de la Ciudad de México, 9 mil 670 equipos médicos y mobiliario, entre los que se encuentran ventiladores, monitores de signos vitales, electro cardiógrafos, ultrasonido pulmonar y camas hospitalarias, entre otros.
Asimismo, una vez que la Ciudad de México observa la reducción sostenida de contagios, ocupación hospitalaria y lamentables fallecimientos por Covid-19, se decretó la conclusión de operaciones de la Unidad para este 15 de junio.
El Presidente del Consejo de Administración de Grupo Carso, Carlos Slim Domit, dijo que “la Unidad Temporal Covid-19, no es sólo un centro de salud, sino que es un centro de esperanza para superar las adversidades, recuperar la salud y la vida, innovar en beneficio de los demás, hacer las cosas mejor y trabajar todos como equipo por el bien de la sociedad”.
Asimismo, agradeció “al personal de la Unidad Temporal y a sus familias pues han tocado la vida de miles personas, especialmente las nuestras.”
Por su parte, El Presidente de CIE, Alejandro Soberón Kuri, agradeció a Fundación Carlos Slim, cuyo liderazgo hizo viable la Unidad Temporal Covid-19, reconversión inédita en México y la más grande de América Latina.
Explicó que el apoyo fue fundamental para extender operaciones, primero de abril a julio del año pasado, después de agosto a diciembre de 2020 y finalmente, hasta el 15 de junio de este año.
En el acto también se develó una placa que honrará el esfuerzo desplegado por los profesionales de la salud y recordará la reconversión del Centro Citibanamex en la Unidad Temporal COVID-19.
Resultados de la Unidad Temporal COVID-19 en los 14 meses de operación:
9,088 pacientes internados atendidos
13,542 personas diagnosticadas en 8 centros de valoración (triages)
3,481 profesionales han laborado a lo largo de este tiempo en la Unidad Temporal COVID-19
112,555 días/cama liberados de la red hospitalaria de la Ciudad de México
Porcentaje de pacientes recuperados 93.4%
Tasa de letalidad de 3.7%, una de las más bajas registradas en el país
(El diferencial en porcentajes fue trasladado a hospitales del sector salud)
428,384 pruebas de laboratorio y rayos x realizados en la Unidad
52,988 llamadas de seguimiento a pacientes
9,698 capacitaciones a los profesionales de la salud
1,224,816 raciones de alimentos y bebidas servidas a personal y pacientes
1,793 pacientes con puntas nasales de alto flujo
803 pacientes ingresados a terapia intensiva, lo que muestra la ampliación de capacidades realizada
Aplicación a 1,329 pacientes en etapas tempranas del programa de Remdesivir; de ellos 68% incrementaron su probabilidad de mejoría y 57% presentaron menor riesgo de progresión a la enfermedad.
ebv
Cobertura especial coronavirus
Vacuna de AstraZeneca se deja de comercializar por trombosis
En Europa
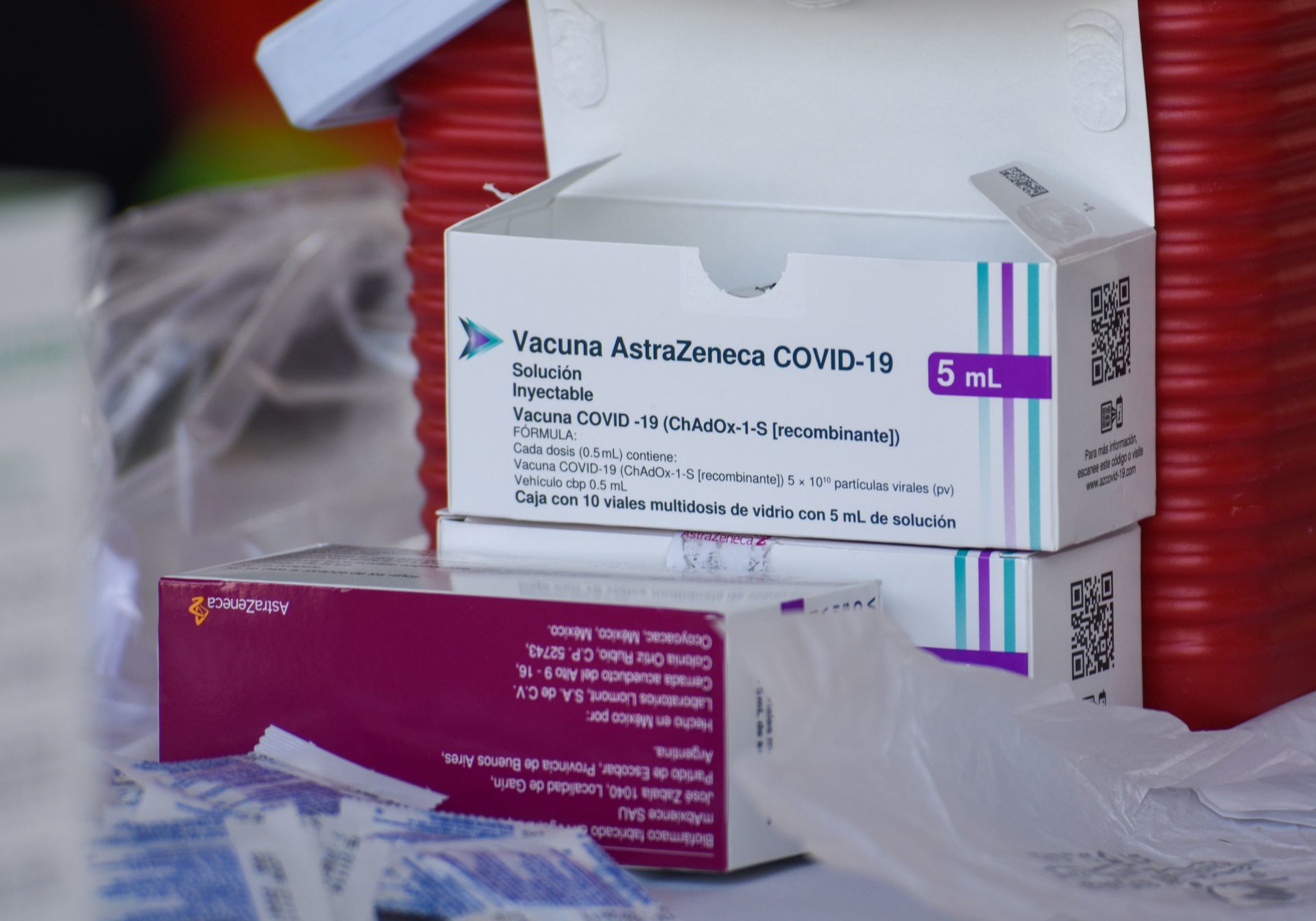
Madrid.— Desde este martes, la vacuna contra Covid-19 que lleva por nombre Vaxzeria desarrollada por AstraZeneca, dejó de comercializarse en Europa.
Lo anterior, luego de que la Comisión Europea validara una petición de la farmacéutica de retirar el biológico el pasado 5 de marzo.
La semana pasada, la compañía farmacéutica AstraZeneca admitió por primera vez que su vacuna contra el coronavirus podía provocar efectos secundarios como la trombosis.
Dicho efecto que ya se notificó en plena pandemia y que provocó la limitación de dicho vial durante el año 2021.
Sobre el tema: AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos ante el Tribunal Superior, y las víctimas y sus familiares en duelo piden daños y perjuicios por un valor estimado de hasta 100 millones de libras esterlinas.
La farmacéutica justificó la retirada de la vacuna contra Covid-19 por la falta de demanda y por el excedente de vacunas disponibles en el mercado.
“Dado que se han desarrollado múltiples vacunas actualizadas para variantes de Covid-19, ahora hay un excedente de vacunas disponibles. Esto ha provocado una disminución en la demanda de Vaxzervria, que ya no se fabrica ni suministra”, indica en un comunicado.
La vacuna de AstraZeneca contra Covid-19 fue la tercera en recibir la aprobación de los reguladores europeos, después de las elaboradas por Pfizer/BioTech y Moderna.
JAHA
Cobertura especial coronavirus
AstraZeneca reconoce que vacuna anticovid puede causar trombosis
Se han presentado 51 casos
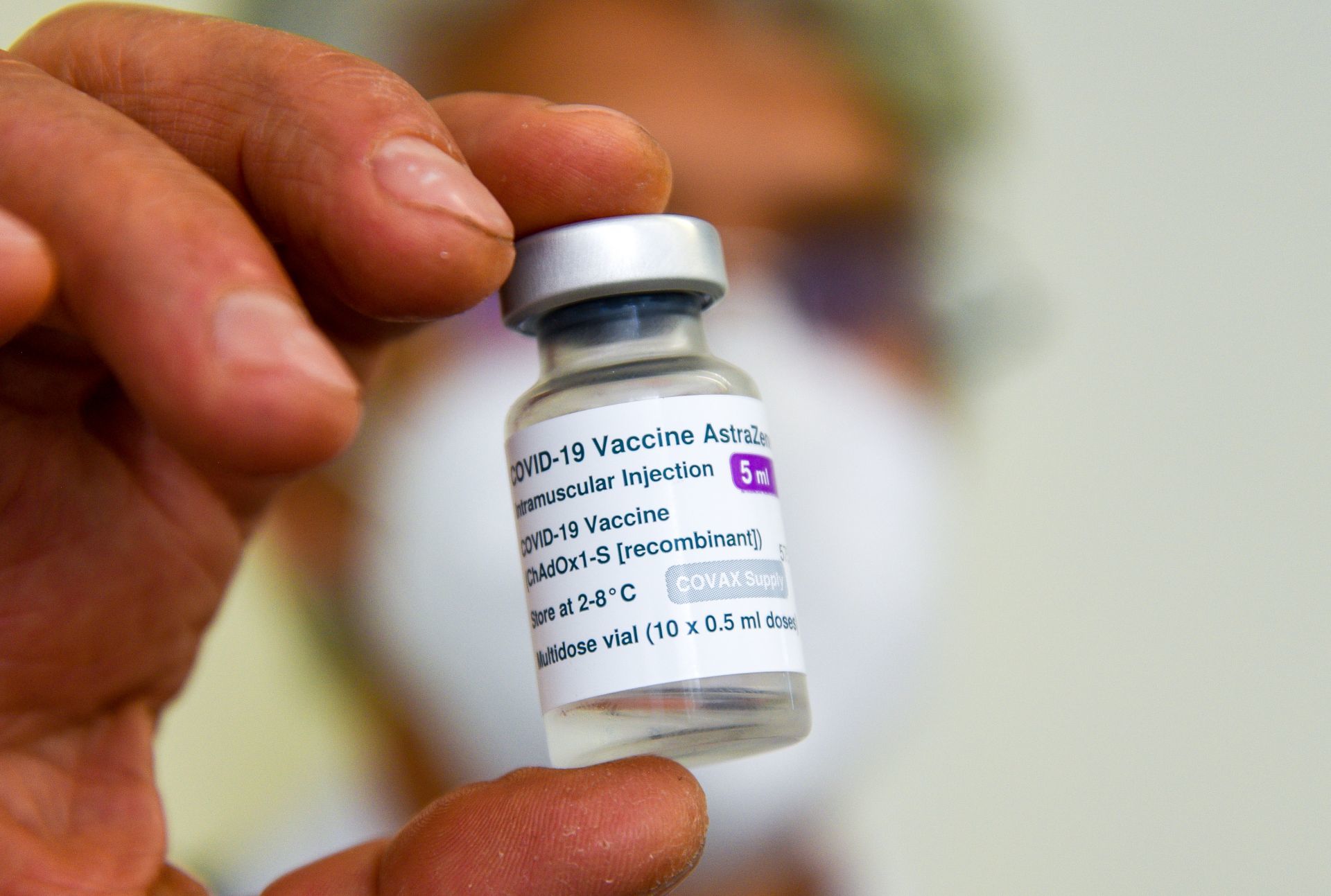
Londres.— AstraZeneca reconoció públicamente, por primera vez en un tribunal que su vacuna contra Covid-19 puede tener un efecto secundario extremadamente raro.
Sin embargo, de presentarse puede ser mortal, pues se puede desencadenar el síndrome de trombosis con trombocitopenia” (TTS).
Usuarios emprendieron en Reino Unido una acción colectiva contra el gigante farmacéutico y su vacuna para el Covid-19, desarrollada junto con la Universidad de Oxford.
Según The Telegraph, AstraZeneca rechazó las demandas, pero aceptó, en un documento legal que su vacuna “puede, en casos muy raros, causar TTS”.
Más para leer: Papa Francisco: “Cambio climático amenaza a Venecia”
Hasta ahora, se han presentado 51 demandas ante el Tribunal Supremo británico. En ellas, las víctimas y sus familiares reclaman una indemnización por daños y perjuicios estimada en 100 millones de libras esterlinas.
No es la única demanda que enfrenta AstraZeneca. En Alemania, un tribunal ordenó a la empresa revelar los datos sobre casos de trombosis posiblemente relacionados con su vacuna.
Lo anterior se da luego de que una mujer de 33 años que reclama una indemnización de 250 mil euros por los dolores que tuvo.
Además de otra de 17 mil 200 euros por concepto de ingresos que dejó de percibir y hasta 600 mil euros por futuras limitaciones.
Por ello, las autoridades solicitaron que AstraZeneca revele los casos de trombosis sufridos por gente que haya recibido la vacuna entre el 27 de diciembe de 2020 y el 19 de febrero de 2024.
La vacuna, según el tribunal, puede en principio favorecer la trombosis. El fabricante ya ha ofrecido información parcial que ahora deberá completar.
JAHA
Cobertura especial coronavirus
Cofepris avala tratamiento oral de Pfizer para Covid-19
Podría ser comercializado

Ciudad de México.— La Comisión Federal para la Protección contra Riesgos Sanitarios (Cofepris) avaló el tratamiento antiviral oral contra el Sars-Cov 2 de Pfizer.
El Comité de Moléculas Nuevas de la Comisión Federal emitió una opinión favorable para dicho tratamiento contra Covid-19.
Hasta el momento, el tratamiento tiene la aprobación para su uso de emergencia en el país.
Sin embargo, la empresa farmacéutica busca la comercialización en todo el país a través de la obtención del registro sanitario ante la Cofepris.
Te recomendamos leer: Pirola en aumento; senadores solicitan informe de variante de Covid-19
Pfizer señaló que el fármaco oral beneficiará principalmente a personas mayores de 50 años para evitar secuelas graves por la enfermedad.
“La opinión emitida por el Comité de Cofepris es, definitivamente, un paso adelante en el cuidado y protección de la población dado que necesitamos todas las herramientas que tengamos a nuestro alcance para disminuir los riesgos del Covid-19, sobre todo en personas mayores de 50 años y con factores de riesgo, quienes continúan siendo las más susceptibles de cuadros graves y hospitalización”, señaló Daniel Bustos, director médico de Pfizer.
Tras la opinión favorable para el tratamiento de Pfizer, la Cofepris deberá anunciar en las siguientes semanas si le concede el registro sanitario a Pfizer.
JAHA

Ciudad de México.— Un nuevo anticuerpo desarrollado en laboratorio logra bloquear todas las variantes del SARS-CoV-2, incluido Omicron y sus subvariantes.
El estudio realizado por expertos españoles, trabaja con un anticuerpo monoclonal. Esta es una proteína del sistema inmunitario desarrollada en el laboratorio, bautizado como 17T2.
El aislamiento del nuevo anticuerpo fue posible gracias a las muestras de sangre de un paciente infectado por el SARS-CoV-2 en marzo de 2020.
A partir de estas muestras, se seleccionaron algunos linfocitos B, las células de la sangre encargadas de producir los anticuerpos.
Te recomendamos: Cadena de farmacias ofrece vacunas contra Covid a menos de mil pesos
Se escogieron aquellos que generaban anticuerpos específicos contra la proteína de la espícula, que es la que permite al virus SARS-CoV-2 infectar las células humanas.
Mediante técnicas de ingeniería genética, el personal investigador reprodujo estos anticuerpos en el laboratorio, en fase preclínica de la investigación.
Los científicos evaluaron in vitro su actividad neutralizante, es decir, su capacidad de unirse al virus y bloquearlo, ante las diferentes variantes del SARS-CoV-2.
Así, los investigadores pudieron seleccionar el anticuerpo que conseguía neutralizarlas todas, incluyendo XBB.1.16 y BA.2.86.
Los investigadores analizaron también en un modelo de ratón no solo la capacidad terapéutica del anticuerpo, sino también la capacidad preventiva.
Descubrieron que reduce de forma significativa las lesiones en los pulmones y la carga viral.
Antes de poder aplicarlo en pacientes habrá que llevar a cabo un ensayo clínico en humanos y, de momento, hay una patente europea activa asociada a este proyecto.
JAHA
-

 Negocioshace 3 días
Negocioshace 3 díasLa cuesta de enero tiene salida: Profeco comparte claves para aliviar el gasto familiar
-

 Mundohace 3 días
Mundohace 3 díasEducar en casa: el aula se muda al hogar y reabre reflexión sobre aprendizaje en los niños
-

 CDMXhace 3 días
CDMXhace 3 díasEl frío no da tregua en la CDMX: alertan por heladas y llaman a proteger a las familias
-

 Culturahace 3 días
Culturahace 3 díasYa cuesta más entrar al Museo de Antropología y visitar Teotihuacán